一、美国疫苗损害补偿制度的历史演进 美国疫苗接种导致损害的事件可追溯至1901年的圣路易斯,13名儿童因接种受污染的白喉抗毒素而死亡;同年,在新泽西州的卡姆登,9名儿童接种受污染的天花疫苗后死于破伤风。在此背景下,美国于1902年7月1日颁布了《生物制品控制法》(Biologics Control Act)。 1955年,美国发生克特(Cutter)疫苗事件,克特公司生产的预防小儿麻痹症疫苗,导致约200名儿童残疾、10名儿童死亡。在判决中,陪审团认为克特实验室在生产脊髓灰质炎疫苗方面并非疏忽大意,但克特公司仍需对产品造成的损害承担经济责任。疫苗无过错责任由此产生。该判例也为此后一系列类似诉讼确立了参照。 1976年至1986年间,疫苗既有可能产生不良反应,也有可能带来质量缺陷层面的问题。百白破疫苗可能导致儿童残疾和发育迟缓,侵权诉讼也随之激增。在国家疫苗损害补偿项目设立之前,疫苗企业面临严重的诉讼威胁,在1980年至1986年间,原告诉疫苗企业的赔偿标的额合计超过35亿美元,与此同时疫苗企业数量由26个减少到4个。疫苗诉讼导致疫苗企业减少,疫苗价格上涨,乃至危及儿童疫苗的供应。 20世纪80年代中期,尽管疫苗侵权诉讼激增,但由于传统救济途径的成本高、效率低,大多数受害人无法从诉讼中获赔,或无法获得足够的赔偿。现行体系既无法保证疫苗的充足供应,又难以保障赔偿。 在多政策源流的共同作用下,历经4年审议,1986年11月14日,时任美国总统里根签署了《国家儿童疫苗损害法》(National Childhood Vaccine Injury Act)。 《国家儿童疫苗损害法》内容包括两部分,第一部分为国家疫苗计划的设立,规定了疫苗相应的研究、配送和使用,确保生产和采购安全有效的疫苗等;第二部分则设立了国家疫苗损害补偿项目(National Vaccine Injury Compensation Program,简称NVICP),该项目秉承无过错补偿进路,替代了传统解决疫苗损害事件的方法,从而对因接种某些疫苗而受到损害的个体给予补偿,这也构成了美国疫苗损害救济的主渠道。 二、美国疫苗损害补偿制度的法律框架 (一)疫苗损害补偿项目的组织架构与资金来源 美国国家疫苗损害补偿项目,内设儿童疫苗咨询委员会(Advisory Commission on Childhood Vaccines)。儿童疫苗咨询委员会的主要职能是,就国家疫苗损害补偿项目的执行和改善,向联邦卫生与公众服务部部长提供建议,内容包括国家疫苗损害补偿项目的实施、疫苗损害列表(Vaccine Injury Table)的修正、减少不良反应的发生、调查联邦及各州的疫苗损害信息等。其中相对重要的职能是,对疫苗损害列表的修正提出建议,因为该表是索偿的重要依据,如果符合列表的要求,即可获得行政补偿。 国家疫苗损害补偿项目有两个不同的经费来源,对于1988年10月1日之前接种疫苗所导致的损害,补偿费用来自国会征收的联邦税。1988年至1992年间,每个财政年度拨付的补偿费用为800万美元,自1993年起每年为1.1亿美元。对于1988年10月1日之后接种疫苗导致的损害,费用来自疫苗损害补偿信托基金(Vaccine Injury Compensation Trust Fund)。该基金设立于美国财政部名下,并接受国会的监督,财政部部长每年须向国会报告疫苗信托基金的财务状况和上一财年的运营情况,以及未来五个财年的预期经营状况。基金的资金来源于对每剂疫苗收取的75美分消费税。 疫苗损害补偿信托基金的运行一直处于良好状态,有效地为受害人提供了足额补偿。截至2018年12月6日,基金约有38.6亿美元,同年的财政年度信托基金总收入大约是3.78亿美元,其中大约3.04亿美元来自税收,470万美元来自此前年度返还金额,0.69亿美元来自利息。 (二)申请补偿的条件与范围 1.申请补偿的条件 申请补偿的条件包括: 其一,申请人需符合资格; 其二,接种的疫苗在损害列表之内; 其三,损害符合法定要求; 其四,符合时效要求。 此外,若申请人因疫苗相关的伤害或死亡已获民事诉讼赔偿或和解,则没有资格再获补偿。 申请人可以是遭受疫苗相关损害的任何人;若受损害者为未成年人或残疾人,则申请人为受损害者的法定监护人;如受损害者因接种疫苗而死亡,则由其法定监护人索偿。申请人遭受损害的程度需满足以下条件之一: 其一,受到疫苗相关的损害持续六个月以上; 其二,因接种疫苗而死亡; 其三,受到疫苗相关的损害,导致住院或接受手术。 就申请补偿的时效而言,以1988年10月1日为界,分为两种情况。在此之前接种疫苗并造成损害,则不得迟于1996年2月1日向索偿法院提交申请,且必须在损害之日起三年内提出。此后发生的所有疫苗损害,必须在发生之日起三年内索偿。对所有在1988年10月1日以后发生的死亡病例,必须在死亡之日起两年内、损害发生之日起四年内提交请求。 2.申请补偿的范围 国家疫苗损害补偿项目规定了补偿的范围和数额。个人因疫苗导致损害或死亡的,可申请补偿以下费用。 (1)自判决之日起发生的实际不可报销费用(unreimbursable expenses)和合理预计的不可报销费用,还包括在判决之前发生的实际不可报销费用。 (2)如受害人未死亡,则可申请补偿收益损失费用。 (3)如果发生与疫苗有关的死亡,则可申请25万美元的补偿金。 (4)针对精神创伤的补偿。 以上各项补偿费用均来自财政部的疫苗损害补偿信托基金。 (三) 申请补偿的程序 1.申请损害救济的两种路径 申请美国疫苗损害救济的路径有两种:一是根据国家损害疫苗补偿项目,向联邦索偿法院提交申请书;二是寻求传统的民事诉讼救济。 但两者之间存在法定顺序,即任何人都不得在州或联邦法院,对疫苗管理者或制造商提起超过1000美元或未指定金额的民事诉讼,州或联邦法院也不得给予超过1000美元的赔偿。只有当个人满足以下条件之一时,可以直接起诉疫苗管理者或制造商: 其一,请求被国家疫苗损害补偿项目判定为不可补偿,项目未被考虑; 其二,个人拒绝国家疫苗损害补偿项目的所有补偿; 其三,疫苗不在国家疫苗损害补偿项目涵盖的范围之内。 根据国家疫苗损害补偿项目索偿的思路有两种: 第一,符合损害补偿表的各项规定即可获得补偿,包括符合损害赔偿表中关于疫苗种类、具体伤害要求以及伤害首次出现的具体时间段等规定。该表为申请人证明疫苗接种与人身损害间的因果关系减轻负担,这是一个有助于快速申请行政补偿的路径。 第二,存在事实因果关系,如果申请人的损害不符合损害赔偿表的要求,则必须以绝对证据证明疫苗造成自身损害。在埃尔森诉卫生与公众服务部部长案中,对“不在列表”(off-table)的索赔请求,联邦巡回法院要求申请人提供优势证据,说明接种导致了对自己的损害,为此确立了三重基准: 第一重,需要有将疫苗和损害的因果关系相关联的医学理论; 第二重着力于论证注射疫苗与发生损害结果之间的逻辑序列,以表明接种是损害的原因; 第三重侧重于接种疫苗与损害之间在时间上的邻近关系。 第一重是理论性的,探讨疫苗是否能导致所指控的损害; 第二重是理论的应用,探讨疫苗是否的确导致了损害; 第三重关注的是症状是否出现于适当的时间点:在接种之后,症状出现得不是太早或太晚。将这三重基准结合起来,当疫苗接种是损害的“必要”(butfor)条件时,则可给予行政补偿。 2.审理程序 个人可以向联邦索偿法院提交申请书,法院收到后交与联邦卫生与公众服务部部长。部长为被告,司法部的律师为被告代理人,在收到申请书之日起30天内,法院需将申请书公布于《联邦公报》(Federal Register)上。此外,联邦索偿法院还需将申请书转交首席特别专员,再由其指定一名特别专员主持索偿的决定。特别专员将以国家疫苗损害补偿项目为依据,在当事人提交申请后240天内,做出是否提供补偿的决定并确定补偿额,暂停时间不计算在内。在特别专员调查结果发布后30天内,若任何一方均未提出复审动议(motion to review),则特别专员的决定将成为联邦索偿法院的调查结果。如果当事人提出复审动议,联邦索偿法院的法官需要在当事人提出起120天内做出支持、撤销或发回特别专员审理的决定。如果任何一方都没有提出异议,或者联邦索偿法院支持特别专员的决定,那么联邦索偿法院必须立即根据特别专员的决定做出判决。判决做出后,如果其中一方仍然反对,则可在60天内向美国联邦巡回上诉法院提出上诉,最终可上诉至美国联邦最高法院。 国家疫苗损害补偿项目是针对疫苗接种伤害儿童的最主要救济措施,但并非唯一的救济措施。在索偿法院根据特别专员决定做出判决或任何上诉判决之后,申请人可以在90天内选择接受判决,或提起损害赔偿民事诉讼。如90天内未提起诉讼,则默示视为接受判决。如果申请人选择接受判决或被视为接受法院判决,则禁止再就同一疫苗相关损害或死亡事件提起损害赔偿的民事诉讼。 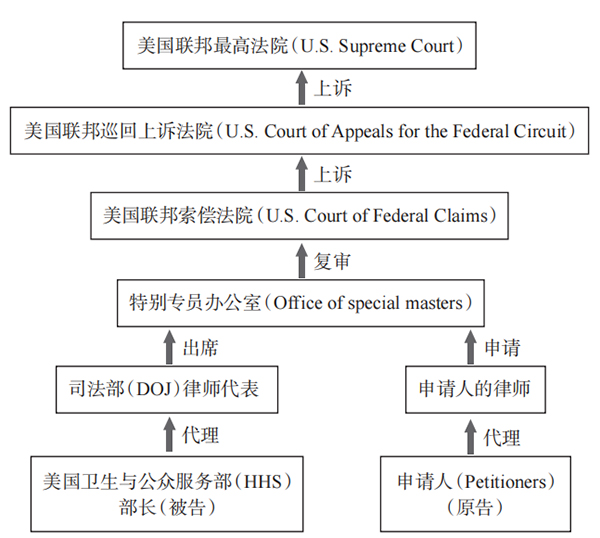 行政补偿审理程序 行政补偿审理程序
(四)疫苗补偿制度的实效 从1989年到2020年8月1日,美国国家疫苗损害补偿项目为8179位申请人提供了补偿,总补偿金额达42.2亿美元。《国家儿童疫苗损害法》确定了疫苗损害补偿的制度框架,建立了疫苗接种“无过错补偿”机制,即只要满足特定条件,无须证明疫苗生产者或行政管理者过错,就可以申请并获得补偿。这部法律提供了简化、便捷的救济方式,更符合成本—收益要求,力求在疫苗受害者和疫苗生产商之间探求平衡。 三、美国疫苗损害补偿制度面临的挑战 美国国家疫苗损害补偿项目的实施一定程度上实现了稳定疫苗供应,为当事人及时提供救济,为疫苗制造商、医生以及其他医疗服务者提供责任保护等既定目标,但也面临索偿途径不畅、申请时效受限等问题,有可能让疫苗研发和生产者规避应有的责任。 (一)索偿路径“堵塞” 通过国家疫苗损害补偿项目请求补偿,包括损害补偿表途径和事实因果关系认定的途径。疫苗损害补偿表作为核心途径,减轻了受害人因果关系证明的负担,是加速赔偿程序的重要机制。 20世纪80年代至90年代,大部分申请人以损害补偿表途径请求补偿。但在进入21世纪后,以此为途径的补偿请求日趋减少。产生这一“反转”现象的原因在于,1995年联邦卫生与公众服务部部长启动了行政规则制定程序,以规则修订了损害补偿表中的“资格与解释辅助”(Qualifications and Aids to Interpretation),例如,就为过敏性反应、脑炎、慢性关节炎等疾病概念和范围给出限定性解释,从而缩小了损害补偿表的适用范围。 自国会通过国家疫苗损害补偿项目以来,卫生与公众服务部部长也很少修改损害补偿列表,即使对损害补偿列表加以修正,在行使修正权时,通常也仅向表中添加新的疫苗种类,但并不添加新的损害症状。这使得申请人无法在损害补偿列表中对号入座,而只能以事实因果关系为由申请补偿,进而很难获得损害补偿,迫使申请人走向传统的损害赔偿民事诉讼,产生“全面走向诉讼”(full blown litigation)的现象。 国会最初设立国家疫苗损害补偿项目并实行疫苗损害列表制度,实际上意在提高补偿效率,让申请人尽快获得补偿,即使在一定程度上牺牲准确性。因此,卫生与公众服务部应以立法目的为出发点,优化疫苗损害列表修改程序,及时采取灵活的行政手段修改损害补偿列表,以应对新的医学发现,为接种受害人提供及时、足额的补偿。此外,国会还应降低事实因果关系案件的证明标准,使之符合“疑点利益有利于受害人”原则,从宽认定疫苗可能为受害事实的原因,而不让受害人承担举证困难带来的不利后果。这不能完全消除受害人在事实因果关系途径中面临的困难,但有助于形成一个便捷、较少对抗性的疫苗损害补偿制度。 (二)申请时效“死板” 一旦申请书的提交超过了规定时效,即便存在合理的原因,法院也不会受理。例如,在2011年克洛尔(Cloer)诉卫生与公众服务部部长案中,克洛尔博士在1996年、1997年接种乙肝疫苗,此后出现多发性硬化症的病状,但当时的医学文献对两者之间的联系没有任何论证。后来克洛尔了解到两者的潜在联系,便根据法律对国家疫苗损害赔偿项目的规定,在首次症状出现的36个月后提出补偿请求,声称接种乙肝疫苗导致自己患有多发性硬化症。 但是,首席特别专员驳回了他的申请书,理由是超过了申请时限,联邦索偿法院也对此予以确认。这也并非个例,在2004年布里斯诉卫生与公众服务部部长案中,布里斯也因为搜集完整的医疗记录和寻找律师,而超过了规定的申请时限,以至于无法请求补偿。 法律规定了疫苗损害补偿的申请时效为两年到四年。但随着医学的发展,医生和科学家也认为疫苗损害不一定即刻发生于接种之后,有时也可能发生于接种后的数年内。因此,应重新考虑疫苗损害补偿的申请时效,并对合理情况设定必要的例外时效规定。 (三)疫苗制造商的“零风险” 国家疫苗损害补偿项目规定,“1988年10月1日以后,如果疫苗制造商在已合理制备疫苗、妥善标明导引和警示时,疫苗的不良反应仍不可避免,那么对于由该不良反应造成的损害或死亡,无须由制造商承担民事赔偿责任”。法条明确规定制造商的制备和警示说明义务,但并未涉及疫苗的研发设计。那么,若由疫苗设计缺陷造成损害或死亡的结果,制造商是否承担民事赔偿责任? 在国家疫苗损害补偿项目中,补偿来自信托基金,其资金来源是消费税,实质上是由接种人承担,制造商没有支出层面的负担。而在补偿项目中,被请求方是卫生与公众服务部部长,故制造商也无须面对补偿请求。疫苗制造商既非国家疫苗损害补偿项目的责任方,又在民事诉讼中受到设计缺陷免责条款的庇护,从而某种意义上处于“零风险”状态。有学者对此现象进行了实证研究,发现自1986年以来,无法就损害赔偿去法院起诉疫苗制造商,这与1986年后监管部门批准疫苗的安全性下降有关联性。  《药品监管制度的法律改革》,宋华琳 著,译林出版社2023年3月版 《药品监管制度的法律改革》,宋华琳 著,译林出版社2023年3月版
(本文摘自《药品监管制度的法律改革》一书,作者宋华琳为南开大学法学院院长、教授,南开大学医药卫生法研究中心主任,主要从事行政法学、医药卫生法研究。出版专著《药品行政法专论》,出版《牛津规制手册》《公共卫生法:伦理、治理与规制》等译著八部,参与《药品管理法》《疫苗管理法》《药品管理法实施条例》等药品法律法规制定和修改的咨询工作。)  海量资讯、精准解读,尽在新浪财经APP
海量资讯、精准解读,尽在新浪财经APP
责任编辑:赵思远 |
仙剑奇侠传3主演无滤镜定妆照,胡歌,杨幂,刘诗诗,唐嫣,霍建华 每个人的造型都好看! 真的是梦回仙剑奇侠传3#了 ,没想到2023年了居然又看到了胡歌杨幂霍建华...
日前,索尼公布了11月PS+会免游戏阵容:《仁王2》PS4|5、《乐高:哈利波特合集》PS4和《Heavenly Bodies》PS4|5三款游戏。 其中的《仁...
热点栏目 自选股 数据中心 行情中心 资金流向 模拟交易 客户端 铜: 隔夜铜价震荡走高,LME上涨0.78%至8960美元/吨,沪铜主力上涨0.64%至694...
说起赤藓糖醇,它这几年可真称得上是代糖界的“顶流”了,去大商超或小便利店的饮料冰柜溜达一圈儿会发现,至少有一半以上的“无糖甜饮料”都使用赤藓糖醇作为甜味剂,零卡...
热点栏目 自选股 数据中心 行情中心 资金流向 模拟交易 客户端 原油: 周四油价涨跌互现,其中WTI6月合约收盘下跌0.04美元至68.56美元/桶,跌幅为0...